@jiyanjiang
2015-10-22T10:36:41.000000Z
字数 4051
阅读 4763
相互作用
量子化学 量子力学
相互作用
薛定谔方程
对中心力场(比如氢原子

四个量子数
这里
轨道(s, p, d)
几率解释
“轨道”

泡利不相容原理
电子不能占据状态相同的轨道;
例:
硼 B (Z=5):
氯 Cl (Z=17):
或:
钙 Ca (Z=20):
多电子原子的填充

洪特定则
1.对未填充满的亚壳层,基态电子倾向于平行排列。
例:C原子:
由于泡利不相容原理,平行排列的电子是互相“排斥”的,这个可理解为2p轨道的电子倾向于更加互相远离对方,以降低系统总能量。
有两个特例
其中半充满或全充满亚壳层会更加稳定:
铬 Cr (Z=24): 不是
铜 Cu (Z=29): 不是
电离能(元素周期律)



薛定谔 说:
在量子论方面,花了1/4世纪以上的时间,直到1926-1927年海特勒和伦敦才给出了化学键量子论的普遍原理。
氢分子(海特勒-伦敦法)
玻恩-奥本海默近似:电子质量远小于原子核,只考虑电子的运动。

分子轨道近似
以上两个波函数满足交换反对称;

氢分子(共价键)
- 数值计算表明:存在稳定的解,对应为氢分子。
- 电子在两H原子核之间几率最大,即:共享电子。
- 原子间距:0.8埃;结合能:3.14eV,实验值:4.48eV。
- A:反键(Anti-Bonding);S:成键(Bonding)
- 共价键的特点:方向性、饱和性、确定的键长、键角
- 现代量子化学计算键长,键角,电离能等的结果非常准确,与实验值吻合很好。

碳原子 杂化轨道

σ 键和π 键
- 头对头(σ键),肩并肩(π键)
- 乙炔
C2H2 :C-C电离能132kcal/mol(1个σ键+2个π键),所有原子在一条直线上,键角180度。键长:1.21埃(直线) - 乙烯
C2H4 :一个σ键和一个π键;C-C电离能:122kcal/mol(1个σ键+1个π键),所有原子在同一平面,键角为120度。键长:1.33埃。(平面) - 乙烷
C2H6 :C-C电离能:83kcal/mol。(1个σ键)。键长:1.54埃。(四面体)

参与形成生物大分子的化学键(共价键)
范德华力
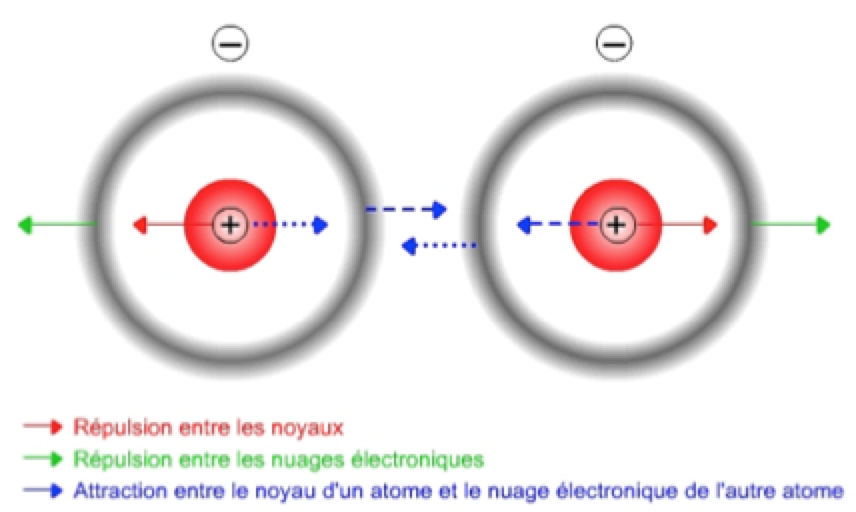
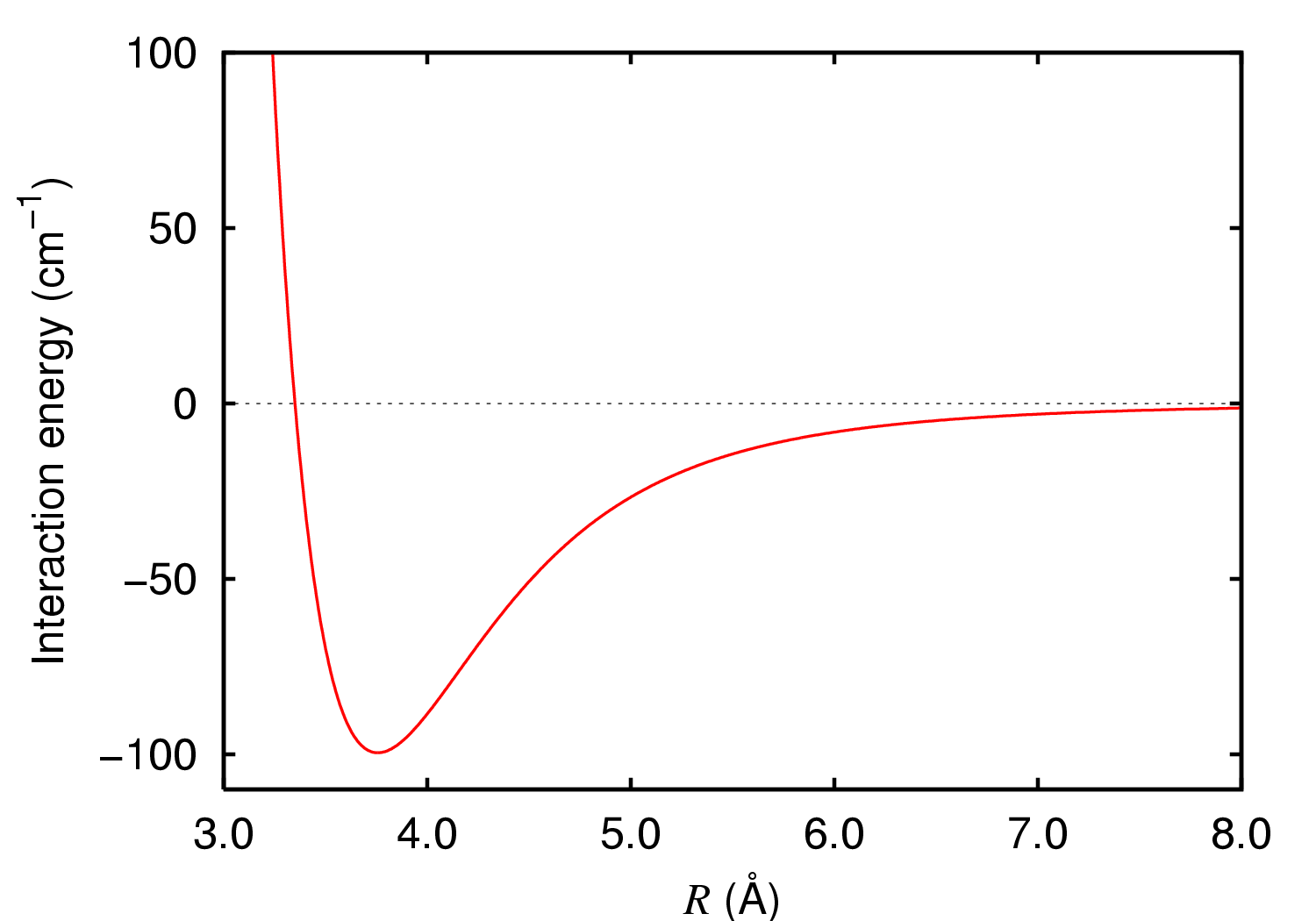
原子(如惰性气体原子)或无极分子中正负电荷系的中心重合,但由于量子涨落效应,某一瞬间正、负电荷中心不重合,呈现瞬时的电偶极矩,而瞬时电偶极矩又会在邻近的原子或分子中产生吸引力,也称色散力,或伦敦(London)力。
短程排斥力是由于泡利不相容原理导致的,由于分子间都是满壳层的,因此两分子(或原子)相互靠近必会占据相同的电子轨道,这被泡利不相容原理所禁止。
范德瓦尔斯力是原子或分子间电偶极子-电偶极子相互作用的统称。与共价键、离子键、金属键相比,范德瓦尔斯力要弱得多,因此也称弱力。如氩(Ar)的范德瓦尔斯键的结合能是:0.088eV/原子 (2.02kcal/mol)。
氢键
强度介于共价键和范德华力之间 (冰中氢键的结合能为0.20eV/原子,或 4.5kcal/mol)
键长、键角、方向性可在相当大范围内变化
可形成于分子间,也可形成于分子内不同部分(如蛋白质、DNA)增大粘度和表面张力


氢键是分子间作用力的一种,比大多数分子间作用力强,但弱于离子键和共价键。在蛋白质、核酸等生物大分子中,氢键可以使大分子不同部分相互作用并最终影响大分子的三维构形。
氢键是电磁相互作用,分子中极性相反的两部分会互相吸引,由氢键这一名称我们知道,相互吸引的其中一部分是氢离子,是电正性的(带正电),另一部分则可能是氧、氮、氟等电负性原子。
氢键的强度
可以很弱(1-2kJ/mol),也可以很强(40kJ/mol),典型的如下表:
| OH...N | OH...O | NH...N | NH...O |
|---|---|---|---|
| 7kcal/mol | 5kcal/mol | 3kcal/mol | 2kcal/mol |
氢键的键长由温度、压强、氢键强度等因素决定,氢键强度由压强、温度、键角和环境(如介电常数)等因素决定。水中典型氢键长度为1.97埃。
氢键存在的重要性
液态水可在很大温度区(100度)间内稳定存在。
盐、碱基、酸、酒精等多种物质可溶于水。
提供了生命活动的环境。
分子的不稳定性
只要不是绝对零度,分子都可能因无规则热能而激发到一个较高能量(这里对应分子不稳定)的状态。
温度越高,跃迁发生的几率越大,所需时间越短。
时间的关系依赖于比值
“期待时间”
| W/kT | t |
|---|---|
| 30 | 0.1秒 |
| 50 | 16个月 |
| 60 | 3万年 |
随机行走
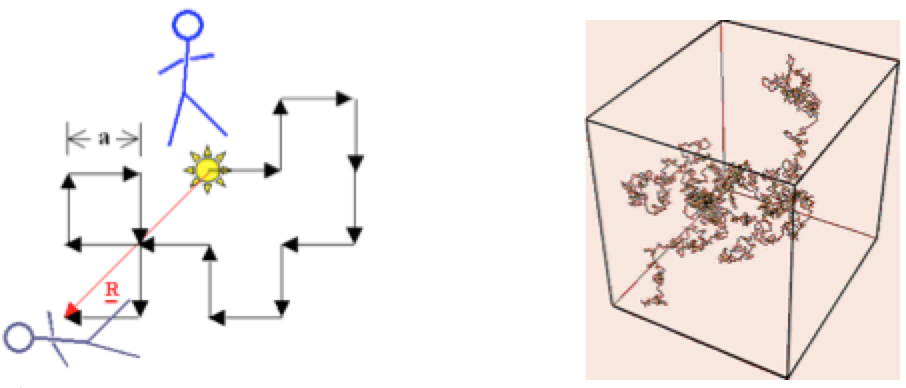
所以
这个结果和维度无关。
