@buoge
2017-09-22T03:03:44.000000Z
字数 567
阅读 1997
热力学的四个定律
自然科学
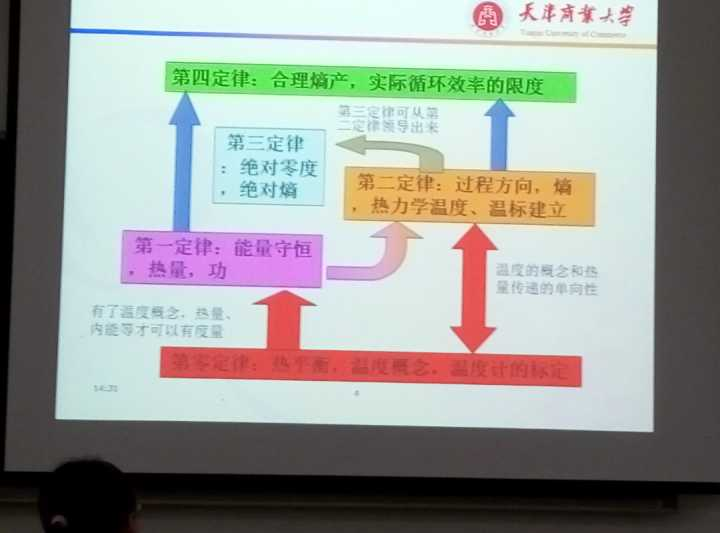
热学第一定律:能量守恒
。如果一个系统处于孤立环境,即不能有任何能量或质量从该系统输入或输出。能量不能无故生成,也不能无故摧毁,但它能够改变形式,例如,在炸弹爆炸的过程中,化学能可以转化为动能。
热学第二定律:熵,热总是从高温物体传到低温物体
不可能把热从低温物体传到高温物体而不产生其他影响,或不可能从单一热源取热使之完全转换为有用的功而不产生其他影响,或不可逆热力过程中熵的微增量总是大于零。又称“熵增定律”,表明了在自然过程中,一个孤立系统的总混乱度(即“熵”)不会减小
热学第三定律:
是对熵的论述,一般当封闭系统达到稳定平衡时,熵应该为最大值,在任何自发过程中,熵总是增加,在绝热可逆过程中,熵增等于零。 在绝对零度,任何完美晶体的熵为零;称为热力学第三定律
(绝对零度,绝热,无法达到,本质上还是混沌的)
热学第四定律:
热力学第三定律——绝对零度不可达到但可以无限趋近
另外一种阐述
1.热力学第零定律——如果两个热力学系统中的每一个都与第三个热力学系统处于热平衡(温度相同),则它们彼此也必定处于热平衡。
2.热力学第一定律——能量守恒定律在热学形式的表现。
3.热力学第二定律——力学能可全部转换成热能, 但是热能却不能以有限次的实验操作全部转换成功 (热机不可得)。
4.热力学第三定律——绝对零度不可达到但可以无限趋近。
